Las reacciones químicas generalmente ocurren en fase disolución, donde el disolvente funge como un agente dispersivo que facilita las colisiones entre las moléculas de los diferentes reactivos. Dada su polaridad y disponibilidad, el agua es uno de los disolventes más utilizados como medios de reacción. Gran parte del análisis químico se realiza en fase acuosa, ya que en este medio muchas sustancias se separan en sus diferentes iones, lo que permite, imponiendo las adecuadas condiciones de reacción, realizar el análisis de estos de manera individual.
Los solutos que son capaces de formar iones cuando se disuelven en agua (o en algunos otros disolventes, principalmente polares) son denominados electrolitos y se caracterizan por su habilidad para transportar corriente eléctrica. Los electrolitos fuertes se ionizan completamente en el medio, mientras que los electrolitos débiles se ionizan solo de manera parcial, a lo que se denomina grado de disociación. Un electrolito muy fuerte tiene un grado de disociación muy cercano al (100%), mientras que el grado de disociación de un no electrolito es cero. La intensidad de la corriente eléctrica que transporta un electrolito débil es por tanto significativamente menor a la que transporta un electrolito fuerte, ya que los iones disociados son las especies transportadoras de carga eléctrica.
La siguiente tabla muestra varios ejemplos de solutos que pueden actuar como electrolitos fuertes o débiles en disolución acuosa (en agua como disolvente). Entre los electrolitos fuertes que se muestran en la tabla se encuentran los ácidos, las bases y las sales.
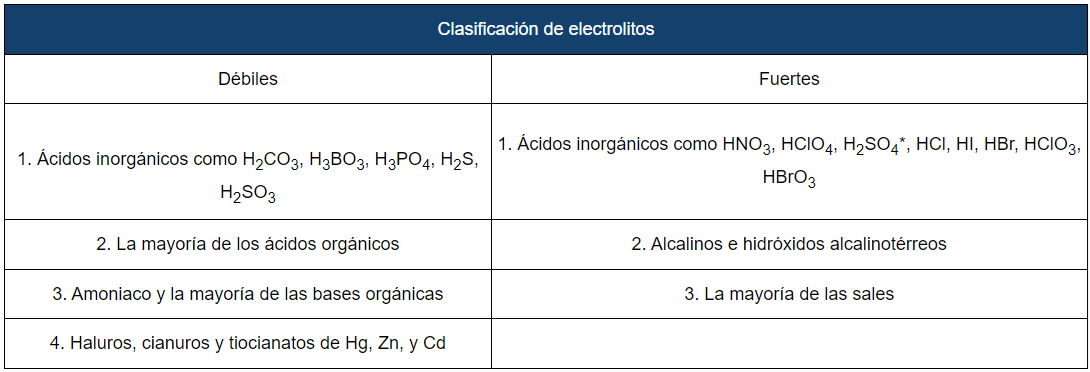
* El $H_2SO_4$ se disocia por completo formando a los iones $HSO^{4-}$ y $H_3O^+$, por lo que se clasifica como un electrolito fuerte. Sin embargo, hay que notar que el ion $HSO_4^-$ es un electrolito débil, ya que solo es capaz de disociarse de manera parcial en $SO_4^{2-}$ y $H_3O^+$.
J. N. Brønsted y J. M. Lowry desarrollaron una teoría sobre el comportamiento ácido/base de los compuestos y elementos. De acuerdo con su teoría, un ácido es un donador de protones, mientras que una base es un aceptor de estos. Para que una molécula se comporte como un ácido, debe encontrarse con un aceptor de protones (o base). De igual modo, una molécula que puede aceptar un protón se comporta como base si se encuentra con un ácido.
Ácidos y bases conjugados
La teoría de Brønsted-Lowry indica que los compuestos pueden mostrar un comportamiento dual ácido-base: un ácido actuará como un aceptor de protones ($H^+$) llamado base conjugada (del ácido original) una vez que ha cedido un protón al medio o a alguna otra especie química. Por ejemplo, considere la situación en donde la especie química Ácido$_1$ cede un protón al medio, transformándose en la especie química Base Conjugada$_1$:
Ácido$_1$ $\rightleftarrows$ Base Conjugada$_1$ + Protón
Ejemplo:
$$HCl \rightleftarrows Cl^- + H^+$$
Siendo $HCl$ el Ácido$_1$ y $Cl^-$ la Base Conjugada$_1$
En el equilibrio, ambas especies pueden coexistir, por lo que en conjunto son denominadas par ácido/base conjugado, o simplemente par conjugado. Por ejemplo, el equilibrio puede también plantearse considerando la situación en donde una base (Base$_2$) acepta un protón para producir un ácido “conjugado” (Ácido Conjugado$_2$):
Base$_2$ + protón $\rightleftarrows$ Ácido Conjugado$_2$
Las reacciones de neutralización son procesos químicos particulares en donde dos pares conjugados reaccionan entre sí,
Ácido$_1$ + Base$_2$ $\rightleftarrows$ Base Conjugada$_1$ + Ácido Conjugado$_2$
La ecuación general de una reacción de neutralización se puede expresar de esta manera:
Ácido + Base $\rightleftarrows$ $H_2O$ + Sal
Ejemplo:
$$HCl + NaOH \rightleftarrows H_2O + NaCl$$
Donde $NaCl$ es la sal.
Especies anfóteras
Las especies químicas que tienen propiedades tanto ácidas como básicas se conocen como anfóteras. Las especies anfóteras (EA) tienen tanto una base como un ácido conjugado asociados, lo cual puede representase en el siguiente par de equilibrios químicos,
EA $\rightleftarrows$ Base conjugada + protón
Ácido conjugado $\rightleftarrows$ EA + protón
Un ejemplo es el ion dihidrógeno fosfato, $H_2PO_4^-$, el cual se comporta como una base en presencia de un donador de protones como lo es la especie $H_3O^+$ (ácido conjugado de la especie $H_2O$), de acuerdo con la siguiente reacción,
$H_{2}PO_{4}^{-}$ (ácido$_1$) + $OH^{-}$ (base$_2$) $\rightleftarrows$ $HPO_{4}^{2-}$ (base$_1$) + $H_{2}O$ (ácido$_2$)
Es de notarse que un disolvente puede también actuar como especie anfótera y un ejemplo claro es el agua, quien puede actuar como ácido o como base, dependiendo de la naturaleza del soluto. Como ejemplo adicional considere una disolución acuosa de amoniaco; el agua es capaz de ceder un protón y actuar así como un ácido con respecto al soluto $NH_3$,
$NH_3$ (base$_1$) + $H_2O$ (ácido$_2$) $\rightleftarrows$ $NH_4^+$ (ácido conjugado$_1$) + $OH^-$ (base conjugada$_2$)
Por otro lado, en una disolución acuosa de ácido nitroso, el agua actúa como un aceptor de protones (o base), de acuerdo con el siguiente equilibrio,
$HNO_2$ (ácido$_2$) + $H_2O$ (base$_1$) $\rightleftarrows$ $NO_2^-$ (base conjugada$_2$) + $H_3O^+$ (ácido conjugado$_1$)
La base conjugada del ácido $HNO_2$ es el ion nitrito. El ácido conjugado del agua es la especie $H_3O^+$.
Otros ejemplos de disolventes anfóteros son el metanol, el etanol y el ácido acético anhidro. Es importante mencionar que existen disolventes que no son anfóteros, pero pueden fungir como aceptor de protones (como el dioxano o la acetona).
Constante del producto iónico del agua
Las disoluciones acuosas contienen pequeñas concentraciones (o trazas) de los iones hidronio e hidróxido, de acuerdo con el siguiente equilibrio de disociación del agua,
$$H_2O \rightleftarrows H_3O^+ + OH^-$$
La constante termodinámica de equilibrio para esta reacción puede representarse de acuerdo con la siguiente expresión,
$$K = \frac{[H_3O^+][OH^-]}{[H_2O]^2}$$
La concentración de agua en una disolución acuosa es significativamente mayor respecto a la concentración de iones hidronio e hidróxido, tal que puede considerarse básicamente constante, en cada uno de los posibles estados de equilibrio. Es por tanto más conveniente reescribir la ecuación anterior de la siguiente manera,
$$K[H_2O]^2 = Kw = [H_3O^+][OH^-]$$
En la cual, el producto de la cantidad $[H_2O]^2$ (una constante) por la cantidad K (otra constante) proporciona a la constante del producto iónico del agua y se expresa como $Kw$, cuyo valor a 25 °C es $1.008 x 10^{-14}$ y suele aproximarse como $Kw = 1.00 \text{x} 10^{-14}$.

